Krystaloidy a koloidy – różnice w infuzji dożylnej oraz rola osocza
Płynoterapia dożylna jest jedną z najpowszechniejszych metod leczenia szpitalnego, nie tylko w stanach zagrożenia życia lub zdrowia, ale także w profilaktyce tych stanów. Dożylna podaż płynów powoduje szybką poprawę stanu pacjenta, wymaga jednak podejmowania ważnych decyzji dotyczących optymalnej objętości, szybkości wlewu oraz co najważniejsze – rodzaju stosowanego płynu. Według aktualnych danych aż 20% pacjentów otrzymujących płyny drogą dożylną dotkniętych jest powikłaniami z powodu błędów w płynoterapii. Z danych zgormadzonych przez Narodowy Instytut Doskonałości Zdrowia i Opieki (ang. National Institute for Health and Care Excellence, NICE) wynika, że duża liczba hospitalizowanych dorosłych pacjentów wymaga płynoterapii dożylnej w celu wyrównania zaburzeń gospodarki wodno-elektrolitowej lub ich zapobiegania [1]. Tymczasem, mimo że płynoterapia parenteralna jest jedną z najczęstszych czynności wykonywanych w oddziałach szpitalnych, niewielu lekarzy czy pielęgniarek przechodzi odpowiednie szkolenia z dożylnej płynoterapii oraz posiada właściwą wiedzę w tym zakresie. Nieprawidłowe zastosowanie tej terapii może być przyczyną wielu działań nie- pożądanych i poważnych powikłań, w tym zgonu, nawet u co piątego pacjenta, u którego zastosowano tę metodę. Nie przestrzeganie procedur związanych z aseptyką podaży roztworów do wlewów (w tym płynów) generuje zakażenia szpitalne, które stają się poważnym problemem wszystkich szpitali – dotyczy 5–10% pacjentów hospitalizowanych. Przyjmując, że 5% pacjentów ulega zakażeniom szpitalnym, roczna liczba zakażeń w Polsce kształtuje się na poziomie ok. 400 tys., a koszty ich leczenia wynoszą aż 800 mln zł rocznie. Najbardziej niepokojące jest, że największy odsetek zakażeń szpitalnych rejestruje się w Oddziałach Anestezjologii i Intensywnej Terapii [2].
Krystaloidy i koloidy jako główne płyny w płynoterapii parenteralnej
Istnieje wiele płynów które można przetaczać, a ich wybór jest uzależniony od stanu pacjenta. Wyróżnić można dwa podstawowe rodzaje płynów, których roztwory są stosowane w płynoterapii parenteralnej – krystaloidy i koloidy. Te pierwsze to wodne roztwory soli mineralnych i soli słabych kwasów organicznych oraz węglowodanów o małej masie cząsteczkowej. Są płynami pierwszego wyboru do płynoterapii dożylnej. W łożysku naczyniowym pozostają stosunkowo krótko, powodując szybkie zwiększenie wodnej przestrzeni pozanaczyniowej (nadmierna i niekontrolowana podaż krystaloidów może prowadzić do obrzęku tkanek). Należy jednak zwrócić uwagę na różno- rodność płynów krystaloidowych, które w różny sposób mogą prowadzić do przesunięć płynowych. Powszechnie zaleca się zbilansowane płyny infuzyjne, gdyż ich użycie zapewnia optymalny efekt terapeutyczny i pozwala uniknąć ryzyka związanego z przetaczaniem płynów niezbilansowanych takich jak np. izotoniczny, ale niefizjologiczny 0,9% roztwór NaCl. Aktualnie przez zbilansowany płyn infuzyjny rozumie się roztwór, który dopasowany do fizjologicznego wzorca elektrolitowego osocza w zakresie jonów Na, K, Mg, Ca, umożliwia zachowanie fizjologicznej osmolalności oraz osiąga fizjologiczną równowagę kwasowo-zasadową dzięki zawartości anionów ulegających metabolizmowi do wodorowęglanów [4]. Oznacza to, że producenci płynów zbilansowanych muszą tak dobrać ilości poszczególnych jonów w roztworze, aby osmolalność płynu infuzyjnego (mOsm/kg H2O) była zgodna z osmolalnością osocza wynoszącą 285– 295 mOsm/kg H2O, gdyż tylko wtedy podaż takiego izotonicznego płynu nie będzie powodowała prze- sunięć płynów pomiędzy przestrzeniami płynowymi organizmu a ilość organicznych anionów, ulegających metabolizmowi do wodorowęglanów, nie spowoduje jatrogennych metabolicznych zaburzeń równowagi kwasowo-zasadowej (alkalozy lub kwasicy) [5]. Nawet niewielkie obniżenie osmolalności osocza z 288 do 280 mOsm/kg H2O skutkuje zwiększeniem ilości płynu w tkankach mózgowia o 3%, powodując zmniejszenie objęto- ści krwi i/lub płynu mózgowo-rdzeniowego (CSF) aż o 30% [6]. Natomiast zmiana osmolarności tylko o 1 mOsm/L wywołuje poprzez barierę krew-mózg siłę o wielkości aż 19mmHg [7]. W pełni zbilansowanym roztworze płynu znaczenie mają nie tylko 4 podstawowe kationy o stężeniach odpowiadających ich zawartości w osoczu, ale także optymalny skład metabolizowanych anionów, aby jego wlew nie powodował zaburzeń równowagi kwa- sowo-zasadowej. Optymalny skład płynu wieloelektrolitowego najlepiej obrazuje fizykochemiczny model Stewarta. Podejście Stewarta tłumaczy między innymi, dlaczego przykładanie wagi tylko i wyłącznie do ilości chlorków w składzie płynu bez równoczesnego wzięcia pod uwagę ilości innych jonów zawartych w roztworze, nie może przełożyć się na właściwą ocenę przydatności terapeutycznej płynu. Infuzja krystaloidowych płynów infuzyjnych wpływa na dwie z trzech niezależnych zmiennych opisanych przez Stewarta, decydujących o pH. Płyny mogą wykazywać różnice w stężeniu silnych jonów (SID) oraz w całkowitym stężeniu nielotnych słabych kwasów/buforów (Atot). Wzrost SID powoduje zasadowicę, a spadek SID kwasicę. Z kolei wzrost Atot wywoła kwasicę, a spadek Atot zasadowicę. Choć SID osocza wynosi około 40 mEq/L, to z oczywistych względów wlew płynu o SID wynoszącym 40 mEq/L wywoła niepożądane zaburzenia równowagi kwasowo-zasadowej. Płyny infuzyjne takie jak krystaloidy nie zawierają słabych kwasów odpowiadających Atot, w związku z czym SID właściwie zbilansowanego roztworu infuzyjnego musi być tak dobrany, aby „równoważyć” zmiany Atot wywołane jego infuzją. Zarówno wyliczenia, jak również dane kliniczne potwierdzają, że SID krystaloidu zbilansowanego w ogóle nie zaburza równowagi kwasowo-zasadowej, gdy wynosi 24mEq/L, przez co płyn o SID zbliżonym do 24 mEq/L jest najbezpieczniejszy [8, 9]. Receptury płynów infuzyjnych wprowadzonych na rynek wiele lat temu sprawiają, że wykonane zgodnie z nimi płyny mają SID o wartościach 43mEq/L i większych, a więc znacząco odbiegają od 24mEq/L. Wlew tych płynów będzie powodował zaburzenia równowagi kwasowo-zasadowej. Wpływ płynu infuzyjnego na równowagę kwasowo-zasadową zależy od SID roztworu, a nie jedynie od stężenia jednego, wybiórczo rozpatrywanego jonu jako składnika płynu. W tym przypadku bardzo dobrym przykładem jest anion chlorkowy i jego stężenie w różnych płynach. W przypadku 0,9% NaCl zawierającego aż 154 mmol/L chlorków, SID = 0, również w przypadku 0,45% NaCl zawierającego 77 mmol/L chlorków, SID = 0, a także 5% r-r glukozy zawierający 0 mmol/L chlorków również posiada SID równy 0. Wszystkie te roztwory mają identyczny SID, więc mają identyczny wpływ na równowagę kwasowo-zasadową, niezależny od stężenia chlorków. Płyn, który w swoim składzie nie ma chlorków wywiera identyczny wpływ na równowagę kwasowo-zasadową jak płyn zawierający 154 mmol chlorków. Przy wyborze płynów warto mieć na uwadze pod- stawową zasadę – wartość ich SID powinna wynosić około 24 mmol/L, a więc powinna być równa fizjologicznemu stężeniu HCO3 we krwi pacjenta, aby uniknąć wystąpienia zaburzeń równowagi kwasowo-zasadowej (ZRKZ) po ich przetoczeniu. Podając płyny z SID 0 <24 mmol/L, a więc z niższym niż stężenie HCO3 w osoczu, wywołuje się kwasicę metaboliczną, podczas gdy przetaczając płyny z SID> 24, a więc wyższym niż stężenie HCO3 w osoczu, doprowadza się do rozwoju zasadowicy metabolicznej. Porównanie składników roztworów krystaloidów podawanych dożylnie w porównaniu z osoczem przedstawiono w tabeli 1.
Tabela 1. Składniki roztworów krystaloidów w porównaniu z osoczem [9, 10].
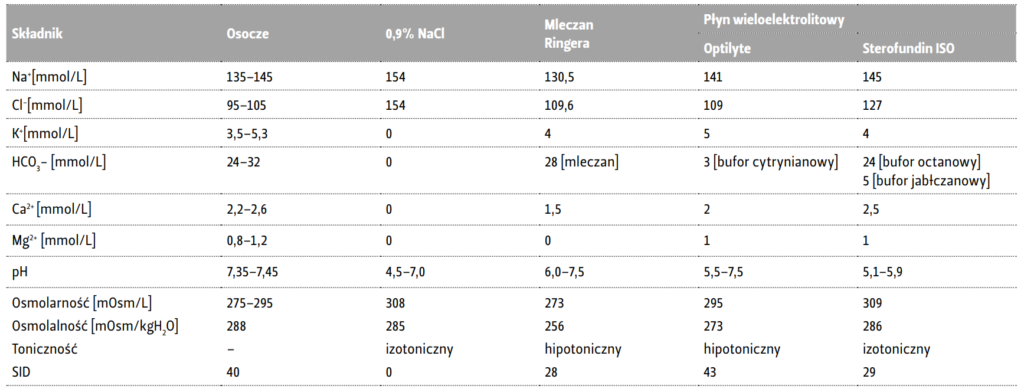
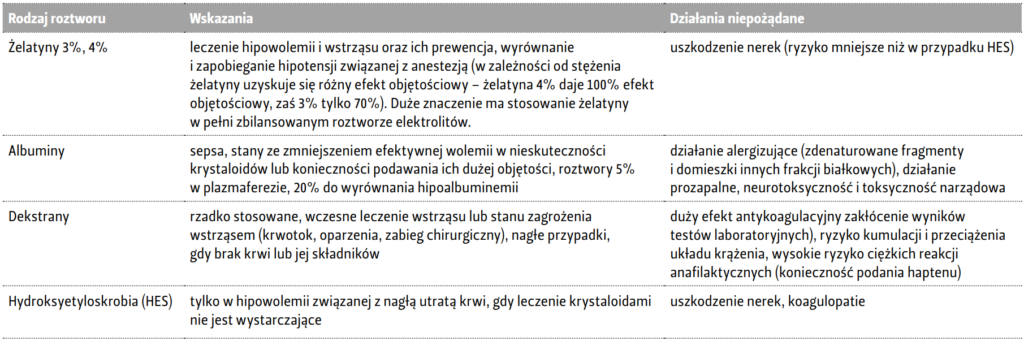
Tabela 2. Główne zastosowania kliniczne koloidów [12, 13].
Koloidy to zawiesiny makrocząsteczek w roztworach niezbilansowanych lub zbilansowanych. Ich zadaniem jest stabilizowanie przestrzeni wodnej wewnątrznaczyniowej, zazwyczaj także ograniczają obrzęk tkanek. Ze względu na pochodzenie cząsteczek, roztwory koloidów dzieli się na: sztuczne (np. roztwory żelatyny, skrobi, dekstranu) oraz naturalne, które są głównie roztworami albumin.
W wyniku podania roztworów koloidów możemy obserwować działanie osoczozastępcze (np. roztwory żelatyny 3% czy 4%, albuminy 4% czy 5%), pozostające w całości w łożysku naczyniowym. Efekt objętościowy, jaki wywołują zdecydowanie zależy od stężenia. Większy efekt objętościowy występuje w wyniku zastosowania żelatyny 4% niż w przypadku żelatyny 3%. Należy pamiętać, że płyny to też leki i ich stężenie ma znaczenie w skuteczności terapii. Dzięki podaniu koloidu możemy zwiększyć objętość osocza, używając np. roztworów hydroksyetyloskrobii (HES), żelatyny czy dekstranu. Substancje te powodują przejście wody do łożyska naczyniowego, zwiększając objętość płynu wewnątrz naczyń krwionośnych [11]. Główne zastosowania kliniczne najczęstszych koloidów przedstawiono w tabeli 2.
Autorzy: Adrian Bryła (Szpital Specjalistyczny im. Ludwika Rydygiera w Krakowie), Małgorzata Zygmunt (Katedra Farmakodynamiki, Zakład Wstępnych Badań Farmakologicznych, Wydział Farmaceutyczny, CMUJ w Krakowie), Krystyna Chmal-Jagiełło1 , Paweł Węgrzyn (Polskie Towarzystwo Farmakologii Klinicznej i Terapii, Wrocław), Michał Steczko (Szpital Specjalistyczny im. Stefana Żeromskiego w Krakowie), Tomasz Buczek (Apteka „Miniszek”, Bogatynia)
Źródło materiału: Magazyn Farmacja Szpitalna, tom 77, nr 4/2021, str. 235-240, ISSN 2544-8552 (on-line), ©Polskie Towarzystwo Farmaceutyczne
—
Źródła:
- Padhi S, Bullock I, Li L i wsp. Intravenous fluid therapy for adults in hospital: summary of NICE guidance. BMJ 2013; 347: 1–5.
- https://podyplomie.pl/medycyna/16727,plynoterapia-parenteralna-w-warunkach-szpitalnych-wytyczne-nice-2013. Dostęp 5.03.2021.
- Zander R. Infusion Fluids: why should they be balanced solutions. Infusion Therapy 2006; 12: 60–62.
- Diagnostyka laboratoryjna z elementami biochemii klinicznej pod redakcja A. Dembińskiej-Kmieć i J. Naskalskiego. Wydanie III poprawione I uzupełnione; Elsevier Urban&Partner 2010.
- Zander R. Fluid Management, Second expanded edition. Bibliomed 2009; 32–39.
- Schell RM, Applegate RL, Cole DJ. Salt, starch, and water on the brain. Journal of Neurosurgical Anesthesiology 1996; 8(2): 183– 184. doi: 10.1097/00008506-199604000-00022.
- Young P i wsp. Effect of a Buffered Crystalloid Solution vs Saline on Acute Kidney Injury Among Patients in the Intensive Care Unit: The SPLIT Randomized Clinical Trial. JAMA 2015; 314(16): 1701–1710. doi: 10.1001/jama.20105.12334.
- Smuszkiewicz P, Szrama J. Teoretyczne podstawy płynotera- pii oparte na fizykochemicznej metodzie Stewarta. Anestezjo- logia Intensywna Terapia 2013; 46(2): 103–110. doi: 10.5603/ AIT.2013.0022.
- Dąbrowski W i wsp. The use of crystalloids in traumatic brain injury. Anaesthesiology Intensive Therapy 2018; 50(2): 150–159. doi: 10.5603/AIT.a2017.0067.
- Boer C, Bossers SM, Koning NJ. Choice of fluid type: physiological concepts and perioperative indications. British Journal of Ana- esthesia 2018; 120(2): 384–396. doi: 10.1016/j.bja.2017.10.022.
Ostatnie wpisy
Historia płynoterapii – w poszukiwaniu idealnego płynu infuzyjnego
Historia płynoterapii
Rozcieńczanie leków w płynach
Webinarium: Płynoterapia – diabeł tkwi w szczegółach
Najnowszy wpis

