Ocena wolemii w badaniu USG – część 1. Płuca

Jak ultrasonograficzna ocena płuc może pomóc w decyzjach dotyczących płynoterapii? Prezentujemy pierwszą część cyklu poświęconego wykorzystaniu USG do oceny wolemii.
Skróty: ALI – ostre uszkodzenie płuc, EVLW – pozanaczyniowa woda płucna, FALLS – płynoterapia ograniczona ultrasonografią płuc, USG – ultrasonografia, OS – przeżywalność całkowita, PD – choroba postępująca, PFS – przeżywalność wolna od progresji choroby
Płynoterapia stanowi niekończące się wyzwanie i przedmiot dyskusji. Przedstawiana seria artykułów postara się przybliżyć kwestię oceny wolemii i odpowiedzi pacjenta na płynoterapię w badaniu USG. Pierwsza część dotyczyć będzie oceny ultrasonograficznej artefaktów pojawiających się w trakcie badania płuc oraz ich możliwej ewolucji w rezultacie prowadzonej płynoterapii.
Ultrasonografia płuc jest jednym z licznych narzędzi mogących pomóc w określeniu skuteczności płynoterapii. Samo obrazowanie płuc w USG jeszcze do niedawna uważano za dziedzinę nieprzydatną. Wynikało to głównie z faktu, iż ultradźwięki ulegają całkowitemu odbiciu na granicy ośrodków o skrajnie różnej impedancji akustycznej uniemożliwia obrazowanie struktur położonych za tą granicą, jednak w wyniku błędnej interpretacji powracającej wiązki ultradźwięków dochodzi do powstania artefaktów, które mają swoje odniesienie w rzeczywistym stanie klinicznym pacjenta.
W badaniu USG płuc wyróżnia się 3 podstawowe artefakty: sliding, linie A oraz linie B.
Linie A (Fot. 1) są poziomymi, linijnymi artefaktami, powstającymi na skutek wielokrotnego zapętlenia się wiązki ultradźwiękowej między czołem głowicy a silnym reflektorem, w tym przypadku opłucną. Powstanie linii A świadczy o obecności powietrza za granicą ultradźwięków. Z kolei artefaktem, który potwierdza tarcie opłucnych względem siebie i równocześnie wyklucza obecność odmy opłucnowej jest sliding. Jest do dynamiczny artefakt powstający na skutek tarcia opłucnych względem siebie (Fot. 2). Przybiera on formę przesuwających się hiperechogenicznych nierówności na linii opłucnej. Ostatecznym potwierdzeniem kontaktu opłucnej płucnej z opłucną ścienną jest obraz „morza i piasku” w projekcji M-mode. Trzecim artefaktem są artefakty linii B, określane również jako „ogon komety” – są to pionowe artefakty, które zawsze spełniają 3 warunki: zaczynają się od poziomu opłucnej, przebiegają przez całą długość ekranu oraz ich ruch jest zgodny z ruchem opłucnej w trakcie oddychania pacjenta (Fot. 3). Dodatkowo najczęściej nie współistnieją z liniami A oraz wykluczają obecność odmy, impedancji akustycznej, jak np. na granicy tkanki miękkiej i okostnej czy na granicy mięśni międzyżebrowych i opłucnej.

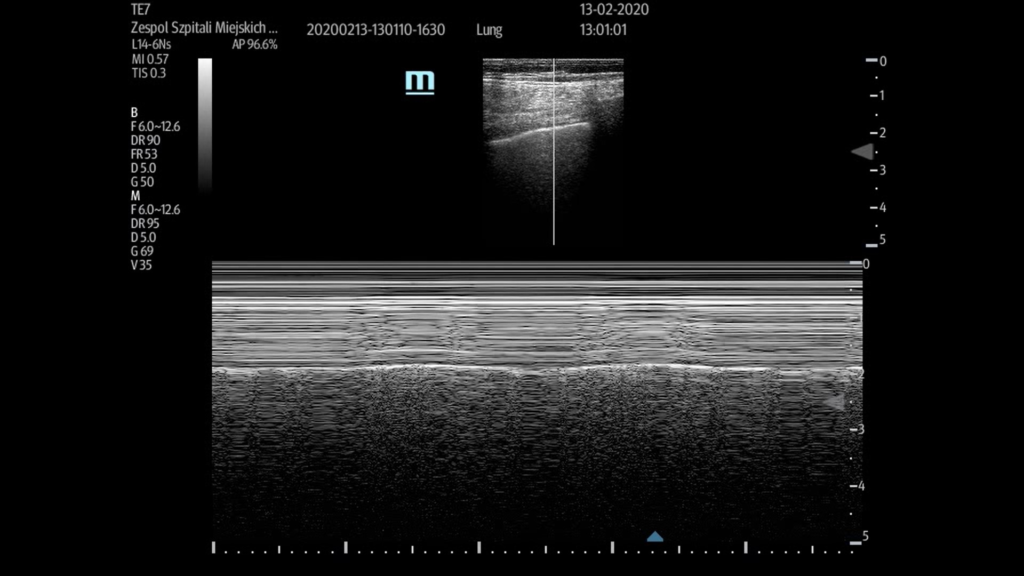
W przypadku badania płuc kluczowy jest wybór presetu. Z uwagi na fakt, że w trakcie badania ocenie podlegają błędy obrazowania, preset przeznaczony do badania płuc powinien być pozbawiony wszelkich aplikacji i algorytmów wzmacniających obraz i redukujących liczbę artefaktów. W nowszych aparatach najczęściej występuje fabryczny preset „Lung”, w starszych konstrukcjach wybór powinien paść na preset o najsurowszym obrazie lub ręcznym wyłączeniu wzmacniaczy obrazu. Badanie płuc można wykonać każdą dostępną głowicą, jednak pionowe artefakty linii B, na których należy się skoncentrować, oceniając efekty płynoterapii, są lepiej widoczne w głowicach o niższych częstotliwościach. Przykładając głowicę w płaszczyźnie strzałkowej, należy zlokalizować tzw. przestrzeń Merlin, czyli okno akustyczne umożliwiające penetrację ultradźwięków w głąb klatki piersiowej ograniczoną dwoma sąsiadującymi żebrami (Fot. 1).
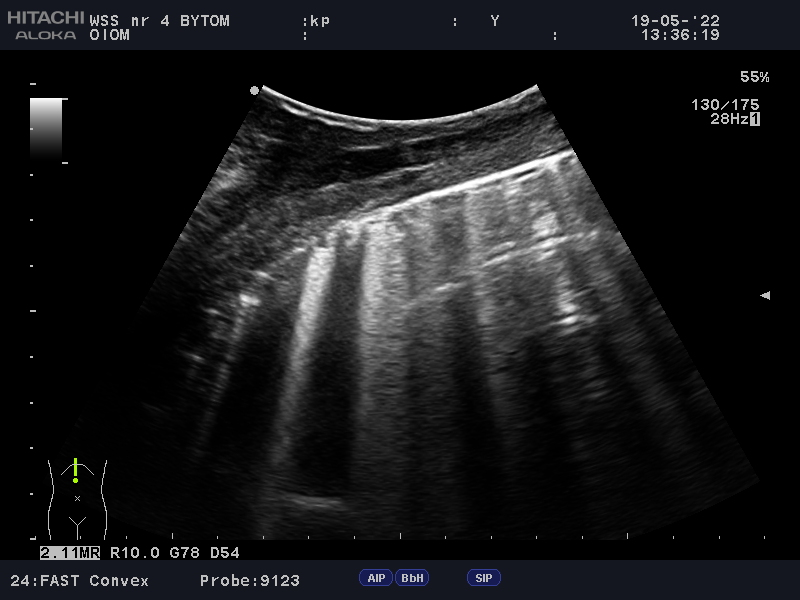
Fizjologiczny obraz płuca ma obraz profilu A – czyli obraz, w którym sliding jest obecny oraz dominują artefakty linii A. Występowanie maksymalnie dwóch artefaktów linii B w jednej przestrzeni nie świadczy o żadnej patologii, zwłaszcza jeśli będą się one lokalizować w częściach przypodstawnych płuc. Dopiero wystąpienie trzech i więcej linii B świadczy o zaburzeniu w równowadze pomiędzy komponentą powietrzną i płynową miąższu płuca – taki obraz pozwala przyporządkować danemu płucu profil B. Do zjawiska tego dochodzi w wielu jednostkach chorobowych, jak np. w zapaleniu płuc, ARDS czy obrzęku płuc. Podstawą w interpretacji obrazu USG jest kontekst kliniczny, rozkład linii w poszczególnych częściach płuc oraz ich liczba. W przypadku obrzęku płuc linie B będą rozkładały się symetrycznie po obu stronach klatki piersiowej, a ich liczba powinna się zwiększać w kierunku obszarów przypodstawnych. Udowodniono ponadto, że liczba linii B jest wprost proporcjonalna do liczby EVLW1. Fenomen ten wykorzystuje się m.in. w protokole FALLS i częściowo może być wykorzystywany do oceny skuteczności płynoterapii1.
W założeniu protokół ten powstał w celu ultrasonograficznej oceny źródła wstrząsu (FALLS Chart). Na początku należy wyeliminować obturacyjną przyczynę wstrząsu –za pomocą podstawowej echokardiografii należy ocenić serce pod kątem występowania objawów tamponady i zatorowości. Jeśli żaden z objawów ww. zespołów nie występuje, następnym krokiem jest ultrasonograficzna ocena płuc. Potwierdzenie slidingu wyklucza odmę opłucnową i zarazem eliminuje trzecią możliwą przyczynę wstrząsu obturacyjnego. Równocześnie ocenie podlega profil płuca – rozsiane, liczne i symetrycznie układające się pionowo artefakty odpowiadają płucu o profilu B. Powyższa sytuacja przemawia za obrzękiem płuc i sugeruje kardiogenną przyczynę wstrząsu. Natomiast dominacja artefaktów horyzontalnych przypisuje płucu profil A oraz kieruje badającego do ostatniego punktu protokołu, tj. oceny odpowiedzi chorego na płynoterapię. Jeśli w trakcie przetaczania płynów w badanych przestrzeniach zaczynają dominować pionowe artefakty linii B, przemawia to za septyczną przyczyną wstrząsu i może przepowiadać brak poprawy, a nawet pogorszenie stanu klinicznego pacjenta przy dalszej płynoterapii. W przypadku gdy stan chorego ulega poprawie i w dalszym ciągu dominującymi artefaktami są linie A, obraz ten przemawia za rozpoznaniem wstrząsu hipowolemicznego oraz pozytywnej odpowiedzi pacjenta na płynoterapię. Jak już ustalono, linie B świadczą o zwiększonej ilości pozanaczyniowego płynu w śródmiąższu płuc, a narastanie ich liczby w trakcie przetaczania płynów świadczy o zwiększającym się przeciążeniu lewej komory. Objaw ten ma również miejsce jeszcze przed wystąpieniem klinicznych objawów obrzęku płuc i ALI3. Jest to też moment, w którym zgodnie z protokołem FALLS powinno zakończyć się przetaczanie płynów, gdyż z dużym prawdopodobieństwem nie przyniesie to dalszych korzyści pacjentowi (Fot. 4; Fot. 5). Podobny schemat badania może być użyteczny w ocenie odpowiedzi pacjenta na płynoterapię w trakcie znieczulenia ogólnego4.
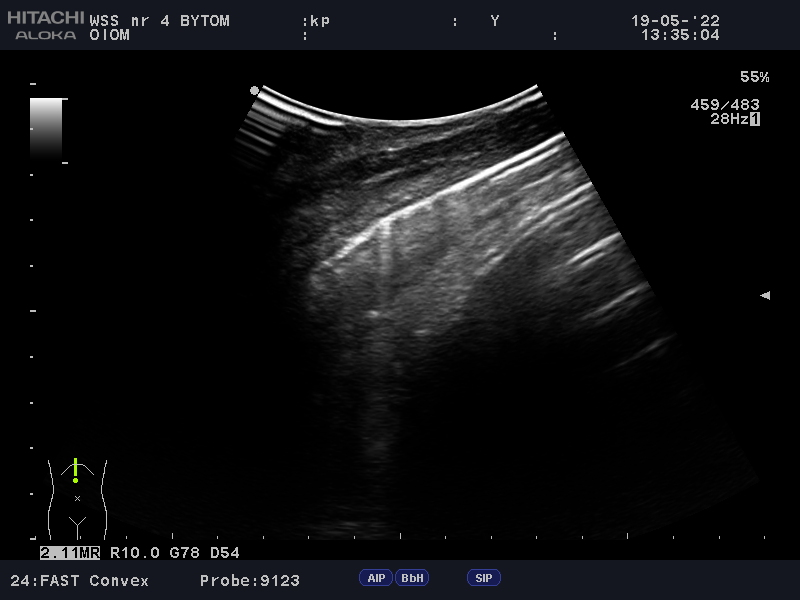
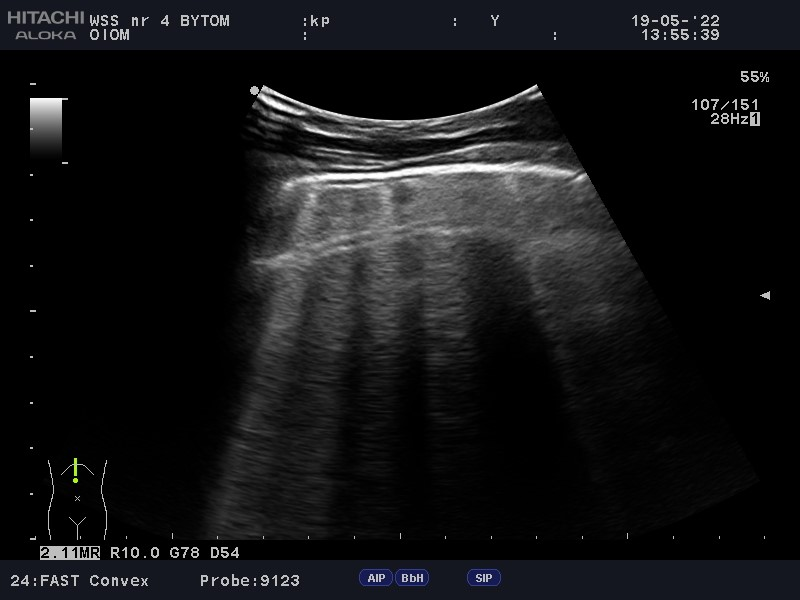
Podsumowując, zmiana profilu płuca na profil B oraz przyrost liczby pionowych artefaktów w trakcie przetaczania płynów prawdopodobnie świadczy o braku odpowiedzi pacjenta na przetaczane płyny oraz sugeruje zmianę postępowania.
Autor: lek. Bartosz Wilczyński, Wojewódzki Szpital Specjalistyczny nr 4 w Bytomiu
Więcej na stronie: medycyna praktyczna
Źródło: medycyna praktyczna
Piśmiennictwo:
1. Picano E. i wsp.: Ultrasound lung comets: a clinically useful sign of extravascular lung water. J. Am. Soc. Echocardiogr. 2006; 19(3): 356–363. doi: 10.1016/j.echo.2005.05.019. PMID: 16500505.
2. Lichtenstein D.: FALLS-protocol: lung ultrasound in hemodynamic assessment of shock. Heart Lung Vessel. 2013; 5(3):142–147. PMID: 24364005; PMCID: PMC3848672.
3. Gargani L. i wsp.: Early detection of acute lung injury uncoupled to hypoxemia in pigs using ultrasound lung comets. Crit. Care Med. 2007; 35(12): 2769–2774. doi: 10.1097/01.CCM.0000287525.03140.3F. PMID: 17828031.
4. Bar S. i wsp.: Assessment of fluid unresponsiveness guided by lung ultrasound in abdominal surgery: a prospective cohort study. Sci. Rep. 2022; 12(1): 1350. doi: 10.1038/s41598-022-05251-6. PMID: 35079044; PMCID: PMC8789825.
Ostatnie wpisy
Historia płynoterapii – w poszukiwaniu idealnego płynu infuzyjnego
Historia płynoterapii
Rozcieńczanie leków w płynach
Webinarium: Płynoterapia – diabeł tkwi w szczegółach
Najnowszy wpis

